1定义
SEC方法按其淋洗体系通常分为两大类,即水相SEC(也称凝胶过滤色谱)和有机相SEC(也称凝胶渗透色谱)。两种方法的分离原理虽然是相同的,但柱填料及其分离对象和使用技术完全不同。
[1]
2发展历史
在文献上,体积排除色谱的名称曾很混乱,这是由于其发展历史及所用分离材料的不同等因素所造成的。
1953年,Porath和Flodin首先用交联葡聚糖凝胶在水溶液中分离水溶性高分子。这种交联葡聚糖凝胶的商品名称,即是后来广为人们所知的Sephadex。由于其突出的优点,立即得到了生化界的承认和广泛的应用。这种分离技术被称为凝胶过滤(gel filltration chromatogr.)。
在水溶液体系中的成功,促使人们去研究非水有机溶剂体系中的凝胶色谱。1964年,Moore以苯乙烯一二乙烯苯共聚物为基质的不同孔径的有机高分子凝胶,解决了分子量几千至几百万的合成高分子的体积排除色谱分离问题。在分离高分子分级与分子量测定领域内,被称之为凝胶渗透色谱(gel permeation chromatogr.)。1965年Waters公司的专用凝胶色谱仪问世(GPC 200)。以后的几年中,从理论到仪器乃至应用等各个方面,凝胶色谱得到了快速发展并日臻完善,成为高效液相色谱家族中重要的一员。
关于名称,20世纪70年代时曾统一为凝胶色谱(gel chromatography)。但是,体积排阻色谱这一名称似乎能更确切地反映其分离过程的本质。因此,以称其为体积排阻色谱为宜。不过,SEC主要的应用领域是生化分离和高分子科学,前者仍习惯地将其称之为凝胶过滤色谱,而后者,更习惯地沿用凝胶渗透色谱的名称。
3优点
与其他几种色谱分离模式相比,体积排阻色谱具有几个突出的优点:
(1)出峰迅速,任何组分的保留体积均在K和%之间;
(2)溶质与固定相(填料)和流动相无相互作用,毋需梯度淋洗;
(3)分离时不会滞留杂质或残留物在柱上,故柱寿命长;
(4)对于大分子,可以测定分子量及分子量分布;
(5)对于生物大分子,有很高的活性回收率;
(6)柱负载较大,利于制备分离。
4缺点
作为一种分离方法,它也有本身难以克服的缺点。即,与其他色谱模式相比,体积排除色谱的分辨率及峰容量均相对较低。
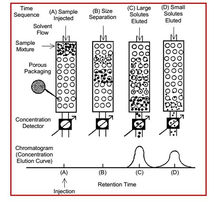
5分离机理

6填料与色谱指标
在SEC方法中,柱填料的性质必须与溶质和淋洗体系相匹配。欲分离的高分子样品可能是油溶性的,也可能是水溶性的,前者只能在有机相体系中分离,后者只能在水相体系中分离,填料必须能被淋洗剂所浸润。SEC方法要求填料与试样尽可能不发生任何基团之间的相互作用,即在色谱过程中应尽可能避免非空间排除效应(如吸附、离子交换、分配等相互作用)的影响,而是完全按照分子尺寸大小进行分离。填料的多孔结构是SEC方法赖以建立的基础。有关填料的孔结构参数(如孔度、孔径、孔径分布以及孔结构形态等)对于SEC技术来说尤为重要。
一种高效的SEC填料,它的化学结构应当能够很好地适应欲分离对象和淋洗体系,并能有效地避免非空间排除现象的发生;它的物理结构除了具备均匀而合适的颗粒度外,还需要有光洁的表面(包括孔壁表面)、规整而通畅的孔结构形态、较大的孑L度以及适当的孔径大小与分布。
SEC填料的色谱表征,除了前面所述的柱效、选择性、分离度、穿透性等参数以外,还需满足如下三项色谱指标要求。







 编辑
编辑

